Fermentación homoláctica: En base a la naturaleza química de las reacciones que tienen lugar y la función de estas dentro de la secuencia global, la fermentación de la glucosa puede describirse como un proceso en tres fases (Brock & Madigan, 1991; Nelson & Cox, 2001) (figura 1):
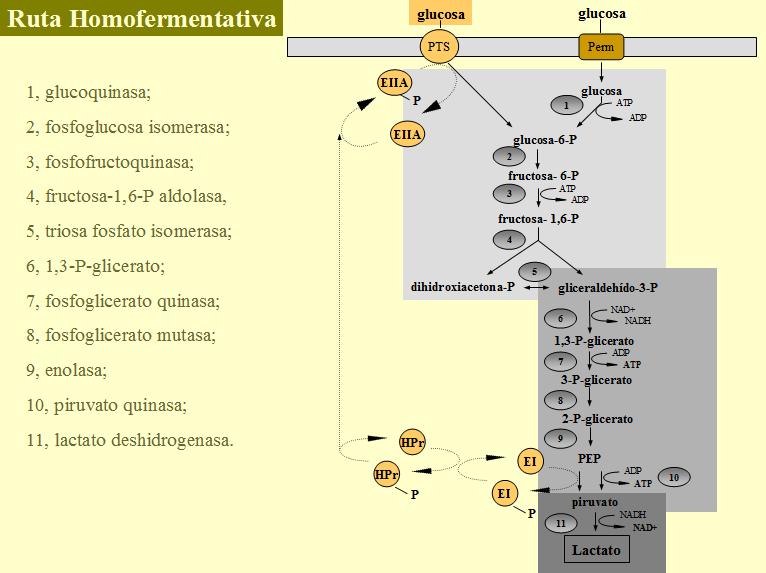
- Fase I: Reacciones preparatorias. Consiste en una serie de reacciones y reordenamientos en la molécula de hexosa que no implican reacciones de oxido-reducción ni liberación de energía. Se forman dos moléculas de gliceraldehído-3-P.
- Fase II: Oxidación y producción de ATP. Se libera energía en forma de ATP y se producen dos moléculas de piruvato. Durante la oxidación del sustrato se reduce el cofactor NAD+ a NADH.
- Fase III: Reducción del sustrato y reoxidación del cofactor. Se regenera el NAD+ para que la ruta pueda continuar.
Las dos primeras fases (la ruta que produce piruvato a partir de glucosa) se denominan glucólisis o ruta Embden-Meyerhof. Es necesario aportar energía a la glucosa para activar la ruta. Durante las reacciones preparatorias (fase I) se dan dos fosforilaciones de la molécula de hexosa, la primera, en el carbono seis, a expensas de ATP por el enzima glucoquinasa, si la glucosa ha sido transportada por una permeasa, o si se ha internalizado por el PTS la fosforilación es simultánea al transporte y en este caso el fosfato proviene del fosfoenolpiruvato. La glucosa-6-P formada es isomerizada a fructosa-6-P por la fosfoglucosa isomerasa y experimenta una segunda fosforilación, es una reacción irreversible en condiciones fisiológicas catalizada por la fosfofructokinasa (dependiente de ATP), para dar fructosa-1,6-P. Esta molécula es escindida por el enzima fructosa-1,6-P aldolasa en dos triosas fosfato, dihidroxiacetonafosfato y gliceraldehído-3-P, siendo interconvertibles por medio de la triosa fosfato isomerasa. A partir de este momento debe tenerse en cuenta que las reacciones que se describen ocurren dos veces por cada molécula de glucosa metabolizada.
El único paso de oxidación (fase II) de la glucólisis es la transformación de gliceraldehído-3-P a 1,3-P-glicerato. El enzima gliceraldehído-3-P deshidrogenasa cataliza esta reacción utilizando NAD+ como cofactor. El grupo aldehído del gliceraldehído-3-P es deshidrogenado a un anhídrido de ácido carboxílico con ácido fosfórico, lo que permite conservar la energía de oxidación del grupo aldehído con la incorporación de fosfato inorgánico a un enlace acilfosfato rico en energía. Durante la deshidrogenación del gliceraldehído-3-P el NAD+ utilizado como cofactor de la reacción es reducido a NADH. El enzima fosfoglicerato quinasa cataliza la transferencia de un grupo fosfato del 1,3-P-glicerato al ADP, produciéndose una molécula de 3-P-glicerato y una de ATP por fosforilación a nivel de sustrato. La fosfoglicerato mutasa cambia la posición del grupo fosfato en la molécula, de 3-P-glicerato a 2-P-glicerato, y la enolasa promueve la deshidratación de 2-P-glicerato a fosfoenolpiruvato. Las dos reacciones anteriores tienen como consecuencia el aumento de la energía de hidrólisis del grupo fosfato, siendo suficiente como para que la piruvato kinasa catalice una segunda fosforilación a nivel de sustrato produciendo piruvato y ATP. La energía contenida en el fosfoenolpiruvato también puede ser aprovechada por el enzima I para autofosforilarse en el caso de transporte por el PTS. El balance neto de la glucólisis es la producción de dos moles de ATP por cada mol de glucosa que entra en la ruta.
Durante la glucólisis, por cada mol de gliceraldehído-3-P oxidado se consume un mol de NAD+ que se convierte en NADH. La cantidad de NAD+ presente en la célula es limitada, para que la glucólisis pueda continuar es necesario regenerar este cofactor a partir del NADH producido (fase III). Para poder reoxidar el NADH a NAD+ ha de emplearse alguna molécula como aceptor de electrones. Esta molécula es el piruvato producido al final de la glucólisis, que en la fermentación láctica es reducido a ácido láctico por el enzima lactato deshidrogenasa con la oxidación simultánea de NADH a NAD+. Esta reacción permite equilibrar el balance rédox de la ruta y que la glucólisis pueda seguir realizandose.
El balance global de la vía homoláctica es la producción de dos moles de lactato (por esto se le denomina fermentación homoláctica) y un rendimiento energético de dos moles de ATP por mol de glucosa fermentada.
Referencias:
Brock, T.D. & M.T. Madigan. 1991. Biology of microorganisms (Sixth Edition). Prentice-Hall International (UK) Limited. London.
Nelson, D.L. & M.M. Cox. 2001. Lehninger Principios de Bioquímica (tercera edición). Ediciones Omega. Barcelona.

