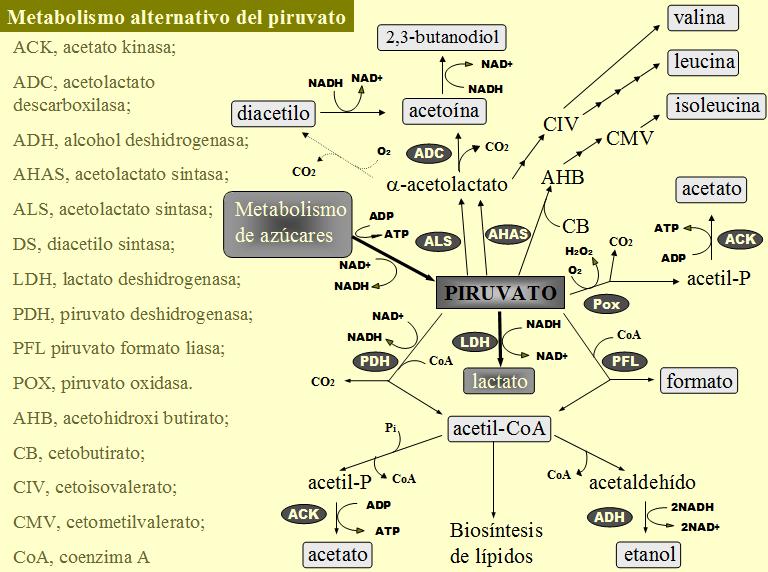
Las NADH oxidasas catalizan la transferencia de electrones desde el NADH al oxígeno. El producto de la reacción es NAD+ y H2O o H2O2, dependiendo de si el enzima cataliza la transferencia de 2 o 4 electrones. Algunas bacterias lácticas tambien disponen de una NADH peroxidasa que utiliza el H2O2 como aceptor de electrones para la formación de agua. Las NADH oxidasas pueden competir con la lactato deshidrogenasa por el NADH, esto origina un exceso de piruvato disponible para ser metabolizado por la ruta de la acetoína / diacetilo. Se ha demostrado un incremento en la producción de acetoína en cultivos en aireación comparados con cultivos anaerobios de L. lactis (Cogan et al., 1989), lactobacilos homofermentativos y Carnobacterium (Borch & Molin, 1989); también se observa un exceso de acetoína por sobreproducción de la NADH oxidasa en L. lactis (de Felipe et al., 1999). Esto no ocurre así en bacterias lácticas heterofermentativas. En ellas las NADH oxidasas no compiten con la lactato deshidrogenasa sino con las acetaldehído y alcohol deshidrogenasas. No se crea un exceso de piruvato y el producto principal de su metabolismo continua siendo lactato, pero si que hay un exceso de acetil-CoA que al no necesitarse como aceptor de electrones puede utilizarse para producir ATP (vía fosforilación oxidativa del acetil-P). Cepas de Leuconostoc sp. en glucosa y aireación aumentan su velocidad de crecimiento, dejan de producir etanol y aumenta la cantidad de acetato producida por la acetato kinasa, lo que incrementa la producción de ATP y el rendimiento (Lucey & Condon, 1986).
Se ha combinado en un experimento de ingeniería metabólica la sobreproducción de la NADH oxidasa con la inactivación de la a-acetolactato descarboxilasa, resultando en una eficiente redirección del flujo de carbono hacia la producción de diacetilo (Hugenholtz et al., 2000)
El oxígeno tiene una fuerte incidencia en el metabolismo de las bacterias lácticas, pero hay que tener en cuenta que no tienen el mismo potencial para protegerse de los efectos tóxicos del oxígeno que las bacterias aerobias. Las bacterias lácticas carecen de catalasa, aunque algunas cepas pueden descomponer el H2O2 por medio de una pseudocatalasa o por una verdadera catalasa si existe grupo hemo en el medio de cultivo (Engesser & Hammes, 1994). Como las NADH oxidasas producen H2O2, su acumulación puede llegar a niveles autoinhibitorios en algunas cepas (Condon, 1987). Algunas bacterias lácticas, como los lactococos y enterococos, poseen superoxido dismutasa, pero no los lactobacilos. Lactobacillus plantarum ha desarrollado un sistema de protección contra el superóxido que consiste en la acumulación intracelular de Mn2+ a altas concentraciones (30-35 mM) que tiene un efecto de detoxificación contra este radical (Archibald, 1986). Este sistema también puede ser utilizado por otras bacterias lácticas que crecen en sustratos vegetales (ricos en Mn2+), como otros lactobacillos, leuconostocs y pediococos.
Referencias:
Archibald, F. 1986. Manganese: its adquisition by and function in the lactic acid bacteria. Crit Rev Microbiol 13:63-109.
Borch, E. & G. Molin. 1989. The aerobic growth and product formation of Lactobacillus, Bochothrix and Carnobacterium in bath cultures. Appl Microbiol Biotechnol 30:81-88.
Cogan, J.F., D. Walsh & S. Condon. 1989. Impact of aeration on the metabolic end-products formed from glucose and galactose by Streptococcus lactis. J Appl Bacteriol 66:77-84.
Condon, S. 1987. Responses of lactic acid bacteria to oxygen. FEMS microbiol Rev 46:269-280.
Engesser, D.M. & W.P. Hammes. 1994. Non-heme catalase activity of lactic acid bacteria. Syst Appl Microbiol 17:11-19.
Hugenholtz, J., M. Kleerebezem, M. Starrenburg, J. Delcour, W. de Vos & P. Hols. 2000. Lactococcus lactis as a cell factory for high-level diacetyl production. Appl Environ Microbiol 66:4112-4.
Lucey, C.A. & S. Condon. 1986. Active role of oxygen and NADH oxidase in growth and energy metabolism in Leuconostoc. J Gen Microbiol132:1789-1796.

