Cuando las bacterias se desarrollan en sus medios naturales suelen tener a su disposición multitud de diferentes sustratos utilizables como fuente de carbono y energía. Ante una mezcla de compuestos, una bacteria adaptará su metabolismo para consumir estos sustratos de manera jerárquica, utilizando en primer lugar los de más fácil metabolismo y reprimiendo la utilización de fuentes de carbono más difícilmente asimilables. Esta estrategia proporciona la ventaja ecológica de poder competir mejor por los recursos frente al resto de la comunidad microbiológica. La descripción de este fenómeno se remonta a experimentos de J. Monod y la observación de que tanto Escherichia coli como Bacillus subtilis al crecer en mezclas conteniendo dos azúcares, utilizaban primero uno, tras lo cual experimentaban una parada, y tras un cierto tiempo de espera se reanudaba el crecimiento, esta vez sobre la segunda fuente de carbono (crecimiento diáuxico). El proceso molecular que desencadena este comportamiento se acuñó posteriormente como represión por catabolito (RC). La glucosa representa el paradigma de azúcar causante de RC, ya que se encuentra entre los más rápidamente utilizables y es capaz de reprimir fuertemente la utilización de otras fuentes de carbono. Las bacterias Gram-negativas y Gram-positivas han desarrollado dos mecanismos diferentes para «sentir» la presencia de carbohidratos extracelulares y regular la expresión de sus genes en consonancia. En ambos casos el sensor esta basado en el PTS (Postma et al., 1993). En Gram-negativos como E. coli, la ausencia de glucosa tiene como consecuencia que un EII específico de este azúcar, el EIIAglc, se encuentre en su forma fosforilada. EIIAglc-P es capaz de estimular la actividad de la adenilato ciclasa, encargada de regular la síntesis de AMP cíclico (cAMP). El cAMP es necesario para la activación transcripcional de numerosos genes catabólicos (regulación positiva) por medio de la proteína CAP (catabolite activator protein) (Botsford & Harman, 1992, Busby & Ebright, 1999). Así, en presencia de glucosa, la defosforilación de EIIAglc lleva consigo la reducción de los niveles de cAMP y la falta de activación de genes para la utilización de fuentes de carbono secundarias (Figura 4).
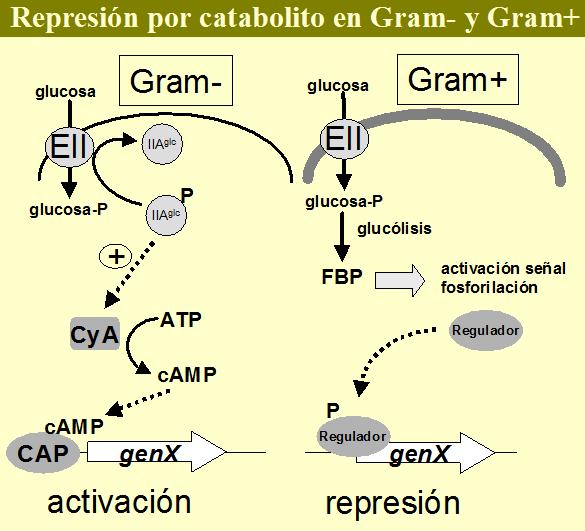
Las bacterias Gram-positivas con DNA de bajo contenido en G+C, al que pertenecen las bacterias lácticas, ha desarrollado otra estrategia para la RC, igualmente basada en el PTS, pero de tipo negativo. En este caso el transporte de glucosa, u otro azúcar rápidamente metabolizable por el PTS, tiene como consecuencia el aumento de la concentración intracelular de intermediarios de la glucólisis, como la glucosa-6-P, fructosa-1,6-P (FBP) o triosas-P. Esto activa una señal de fosforilación de proteínas que determina la unión de una proteína reguladora al DNA, reprimiendo la transcripción de genes del catabolismo de fuentes de carbono secundarias (regulación negativa. Figura 4) (Saier et al., 1995; Deustcher et al., 1997; Deustcher et al., 2001).
A pesar de que algunas bacterias lácticas crecen en ambientes bastante especializados, donde la diversidad de fuentes de carbono fermentables es mínima (por ejemplo en las fermentaciones lácteas), el mecanismo de RC esta presente en este grupo bacteriano. Esto es quizás un reflejo del modo de vida en sus nichos ecológicos iniciales (materia vegetal, tracto intestinal), caracterizados por una compleja presencia de fuentes de carbono. Por otra parte, y como se verá más adelante, la RC sólo puede entenderse dentro de un sistema global de regulación del metabolismo. Los mismos mecanismos que desencadenan la RC, son capaces de llevar a cabo la activación catabólica (AC), o aumento de la expresión de ciertos genes centrales del metabolismo. Estos incluyen genes de la glucólisis, de la excreción de exceso de carbono o del metabolismo de nitrógeno. Por tanto, la RC sólo es un caso particular de la regulación global mediada por la disponibilidad de fuentes de carbono.
Referencias:
Botsford J.L., Harman J.G. 1992. Cyclic AMP in prokaryotes. Microbiol Rev 56:100-122.
Busby S, Ebright RH. 1999. Transcription activation by catabolite activator protein (CAP). J Mol Biol 293:199-213.
Deutscher J, Fischer C, Charrier V, Galinier A, Lindner C, Darbon E, Dossonnet V. 1997. Regulation of carbon metabolism in gram-positive bacteria by protein phosphorylation. Folia Microbiol 42:171-178.
Deutscher J, Galinier A, Martin-Verstraete I. 2001. Carbohydrate uptake and metabolism. En: Sonenschein AL, Hoch, JA, Losick R (eds), Bacillus subtilis and its closest relatives: from genes to cells. American Society for Microbiology, Washington DC. pp.137-158
Postma, P.W., J.W Lengeler and G.R. Jacobson. 1993. Phosphoenolpyruvate:carbohydrate phosfotransferase systems of bacteria. Microbiol. Rev. 57:543-594.
Saier MH Jr, Chauvaux S, Deutscher J, Reizer J, Ye JJ. 1995. Protein phosphorylation and regulation of carbon metabolism in gram-negative versus gram-positive bacteria. Trends Biochem Sci 20:267-271.

