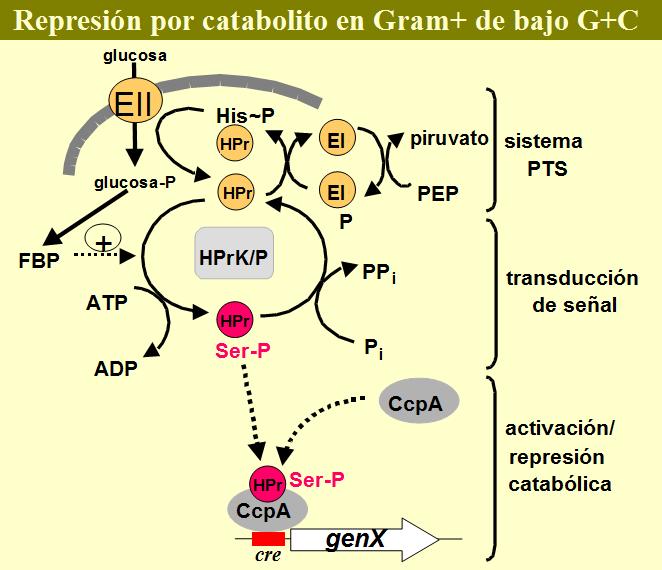
La proteína HPr, codificada por el gen ptsH, es un constituyente esencial del sistema PTS de transporte de azúcares. Se trata de una proteína que puede sufrir dos tipos de modificación postraduccional. La primera modificación es una fosforilación a nivel de la histidina en posición 15, catalizada por el enzima-I a partir del fosfoenolpiruvato y relacionada con el transporte y fosforilación de azúcares (Postma et al., 1993). La segunda modificación es una fosforilación a nivel de la serina 46 en una reacción dependiente de ATP (Deuscher & Saier, 1983; Deustcher et al., 1986). P-Ser-HPr fue descubierta como una proteína que se fosforilaba en Streptococcus pyogenes bajo las mismas condiciones en las que se producía la RC o el fenómeno de regulación del transporte de azúcares denominado expulsión del inductor. El sitio alrededor de la serina 46 está muy conservado en HPr de Gram-positivos, ya que esta segunda modificación es casi exclusiva de estos. P-Ser-HPr constituye la molécula efectora que activa la unión de CcpA a los sitios cre de regulación, y la interacción molecular entre las dos proteínas y con sitios cre en el DNA ha podido ser determinada por distintas técnicas cromatográficas y moleculares (Deustcher et al., 1995; Fujita et al., 1995; Jones et al., 1997; Aung-Hilbrich et al., 2002). Mediante la construcción de cepas mutantes en la serina 46, en las que este aminoácido ha sido reemplazado por aminoácidos no fosforilables, se ha podido establecer en varias bacterias lácticas la implicación de P-Ser-HPr en la regulación por catabolito. Se han construido cepas de L. casei en las que la serina 46 fue reemplazada por el aminoácido no fosforilable alanina (Viana et al., 2000). Las cepas que expresan la forma mutante HPrSer46Ala tienen un fenotipo similar a una cepa mutante en ccpA en relación a la RC de la expresión de actividades enzimáticas como la N-acetilglucosaminidasa o fosfo-b-galactosidasa. Además, sufren una reducción del tiempo de parada diáuxica tras el crecimiento en medios que contienen una mezcla de glucosa y un segundo azúcar como la lactosa, maltosa o ribosa. Cepas de Lc. lactis deleccionadas en el gen ptsH y transformadas con plásmidos a partir de los cuales se puede inducir la expresión de la proteína HPrSer46Asp de B. subtilis, que mimetiza una fosforilación constante en la posición 46, muestran un aumento en las actividades piruvato quinasa o lactato deshidrogenasa (Luesink et al., 1999a). Estas dos actividades están codificadas en el operón las, que en Lc. lactis está inducido por glucosa mediante la acción de CcpA. De igual manera, la transformación con un plásmido que expresa la proteína HPrSer46Ala da lugar a una falta de activación del operón las por glucosa. La mutación Ile47Thr en el gen ptsH fue aislada espontáneamente en Streptococcus salivarius y produce una proteína con una cinética de fosforilación en la serina 46 idéntica a la proteína silvestre, pero con una menor interacción con CcpA (Gauthier et al., 1997). Al igual que en S. salivarius, el reemplazamiento del gen ptsH en L. casei por el alelo con la mutación Ile47Thr produce una cepa afectada en el proceso de RC. La introducción de la mutación HPrSer46Asp en L. casei no ha sido posible (Viana, 2002). Lo que sugiere que una fosforilación constante de HPr en la posición 46 afecta severamente al crecimiento celular al producir una señal de represión por catabolito permanente.
Referencias:

