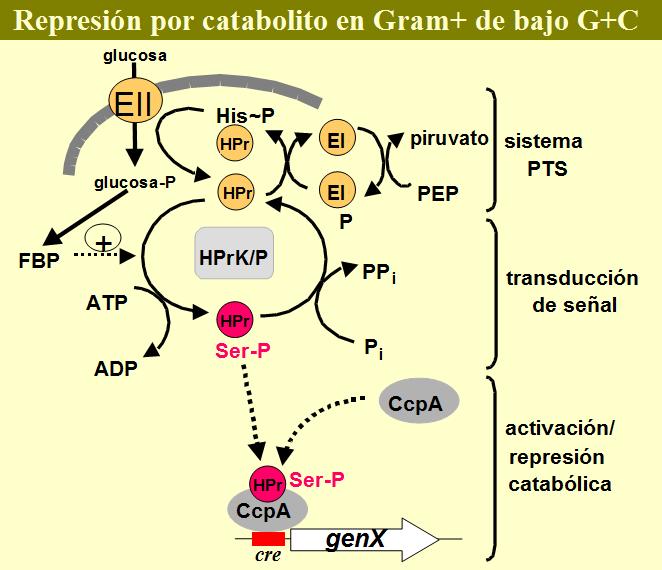
Como se mencionado en el apartado III.1, en contraste con las bacterias Gram-negativas, donde el simple transporte al interior celular de carbohidratos es suficiente para provocar la regulación por catabolito, las bacterias Gram-positivas precisan del metabolismo de este carbohidrato para iniciar el proceso. La fosforilación de HPr en la Ser 46 es un proceso dependiente de ATP y activado metabólicamente (Deustcher & Saier, 1983). El enzima responsable, la HPr quinasa, fue aislado y su gen, hprK, clonado de B. subtilis y E. faecalis y posteriormente caracterizado como un enzima que es activado alostéricamente por intermediarios de la glucólisis; siendo el activador más potente la fructosa-1,6-bifosfato (FBP) (Galinier et al., 1998; Reizer et al., 1998). Desde un principio se había pensado que la actividad fosfatasa que revertía la fosforilación de HPr estaba codificada por un segundo gen diferente a hprK, sin embargo la purificación de la HPr quinasa tanto de B. subtilis como E. faecalis puso de manifiesto que este enzima es bifuncional y puede llevar a cabo las dos reacciones (HPr quinasa/fosfatasa ó HPrK/P) (Brochu & Vadeboncoeur, 1999; Kravanja et al., 1999; Dossonnet et al., 2000; Huynh et al., 2000). La actividad quinasa es activada por FBP mientras que la actividad fosfatasa es estimulada por fosfato inorgánico (Pi). Estos moduladores de la actividad son unos buenos indicadores del estado metabólico de la célula. Cuando las bacterias metabolizan activamente un carbohidrato, el flujo de éste a través de la glucólisis produce un aumento de la concentración intracelular de intermediarios glucolíticos, entre ellos la FBP, que en Lc. lactis puede alcanzar concentraciones de hasta 20 mM. (Thomson & Torchia, 1984; Neves et al., 1999). Estas concentraciones activan la función quinasa de HprK/P, llevando consigo la formación de P-Ser-HPr y desencadenando así el proceso de regulación catabólica (Figura 5). Por el contrario, bajo condiciones de falta de aporte de carbohidratos, la acumulación de Pi intracelular, junto con el descenso de la FBP, activa la función fosfatasa de HprK/P revertiendo la fosforilación de HPr en la serina 46. Sin embargo, existe toda una variabilidad en la regulación de la actividad de HprK/P según microorganismos. Por ejemplo, en S. pyogenes ó E. faecalis la activación de la función quinasa está regulada en mayor medida por la concentración de ATP, y no por la presencia de FBP (Brochu & Vadeboncoeur, 1999; Kravanja et al., 1999). De cualquier manera, la fosforilación de HPr por HprK/P posee dos requisitos: i) rápido transporte y metabolismo de un carbohidrato y ii) HPr debe de estar en su estado no fosforilado, ya que la forma P~His-HPr es lentamente fosforilada en la serina y HPr doblemente fosforilado (2P(His, Ser)-HPr) no interacciona con CcpA. Estos requisitos se cumplen perfectamente cuando un azúcar transportado por el PTS es metabolizado: el fosfato de P~His-HPr es destinado al transporte por el PTS, con lo que gran parte del HPr celular se transforma en HPr no modificada y, por otra parte, el hecho de que los azúcares transportados por el PTS entren en la célula ya fosforilados acelera su entrada en la glucólisis y por tanto su metabolismo, dando lugar a la elevación de los niveles intracelulares de FBP y ATP.
Se han obtenido mutantes por disrupción de hprK en B. subtilis, L. casei y S. xylosus (Gallinier et al., 1998; Dossonnet et al., 2000; Huynh et al., 2000) y en todos los casos se produce una pérdida de la RC similar a la obtenida en un mutante ccpA ó, en el caso de L. casei, a la obtenida también por la introducción de la mutación Ser46Ala en el gen ptsH. De igual modo, extractos de L. casei mutante en hprK pierden tanto la capacidad de fosforilar HPr como de defosforilar P-Ser-HPr (Dossonnet et al., 2000), indicando que posiblemente no existe otra actividad en este organismo encargada de estas funciones.

