En L. casei, el operon lac esta reprimido por glucosa e inducido por lactosa. La represión por glucosa es ejercida a través de P-Ser-HPr y CcpA por unión a la secuencia cre (Monedero et al., 1997) y la inducción por lactosa está mediada por LacT, una proteína que pertenece a la familia BglG de antiterminadores transcripcionales (Alpert & Siebers, 1997; Gosalbes et al., 1997).
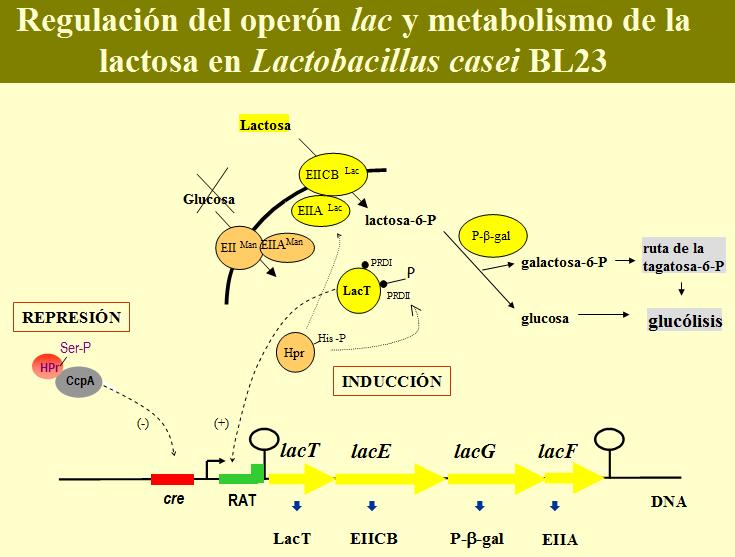
Cuando células de L. casei crecen en una mezcla de glucosa y lactosa, la glucosa es fermentada en primer lugar. A este proceso le sigue una parada en el crecimiento de unas 15 a 20 horas (parada diaúxica), que representa el tiempo que las células precisan para inducir los genes lac para el metabolismo de lactosa. Esta parada es seguida por un crecimiento a expensas de lactosa (Veyrat et al., 1994). En un mutante ccpA, la utilización preferencial de glucosa sobre lactosa sigue existiendo, aunque la parada diauxica queda reducida a unas 2 ó 3 horas (Monedero et al., 1997). Esto implica que un mecanismo adicional de RC sigue activo en este mutante. Este mecanismo está basado en el regulador LacT.
Se han caracterizado proteínas homólogas al antiterminador LacT, como BglG en Escherichia coli (Schnetz & Rak, 1990; Amster-choder & Wright, 1992; Görke & Rak; 1999; Chen et al., 2000) y SacT, SacY, LicT y GlcT en Bacillus subtilis (Débarbouilé et al., 1990; Schetz et al., 1996; Tortosa et al., 1997; Stülke et al., 1997; Idelson & Amster-Choder, 1998). Además de LacT en Lactobacillus casei, se han encontrado otros antiterminadores en bacterias lácticas, como BglR en Lactococcus lactis y BglG en Lactobacillus plantarum (Bardowski et al., 1994; Marasco et al., 2000).
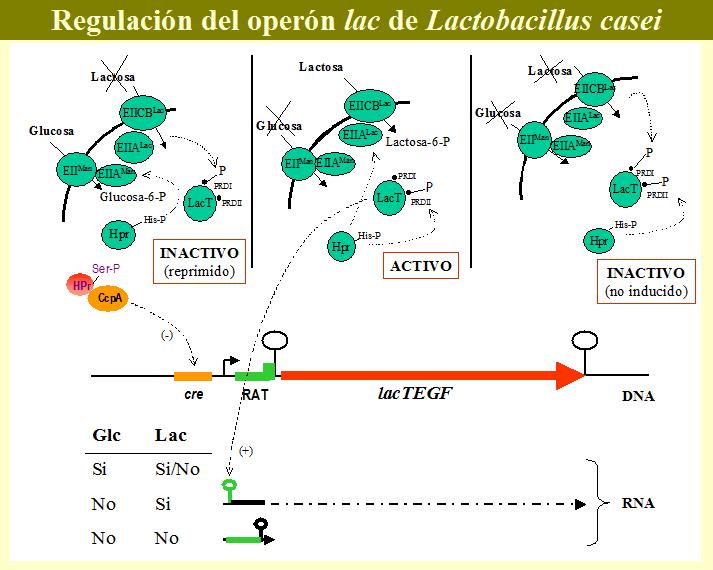
LacT está formado por tres dominios: un dominio de unión al RNA y dos dominios reguladores PRD (PTS regulated domain), denominados PRD-I y PRD-II. La regulación de estos dominios se produce por fosforilación / desfosforilación. En ausencia de inductor el antiterminador está inactivo y la transcripción se lleva a cabo hasta que la RNA polimerasa llega al terminador, produciendose un pequeño transcrito de unos 100 nucleótidos (Gosalbes et al., 1999). El hecho de que mutantes en lacE y lacF presenten una actividad antiterminadora independiente de la presencia de inductor, sugiere que, en ausencia de lactosa que transportar, las proteínas del PTSlac inactivan la actividad antiterminadora de LacT, probablemente por fosforilación en el PRD-I (Gosalbes et al., 1999). La represión catabólica independiente de CcpA del operón lac precisa de un transporte funcional de glucosa a través del PTSman (Gosalbes et al., 1999), relacionando la inactivación por glucosa de la actividad antiterminadora de LacT con el EIIman u otros elementos del PTS. El modelo de control mediado por PTS de reguladores que contienen PRDs (Stulke et al., 1998) podría la explicar la regulación de la actividad de LacT. Según este modelo, la actividad de los antiterminadores se regula por el estado de fosforilación de los dominios PRD, estando uno relacionado con regulación negativa (su fosforilación disminuye la actividad) y el otro positiva (su fosforilación aumenta la actividad). En ausencia de glucosa y del sustrato del operon regulado, todas las proteínas del PTS se encuentran fosforiladas, el PRD implicado en la regulación negativa del antiterminador es fosforilado por los componentes EII del PTS especifico del sustrato en ausencia de inductor y el PRD que interviene en la regulación positiva se fosforila por P-His-HPr en ausencia de glucosa, dando un antiterminador inactivo por falta de inducción. En presencia del inductor, el PTS específico transfiere el fosfato al sustrato transportado, dejando de fosforilar el PRD implicado en la regulación negativa de la actividad (incluso puede desfosforilarlo (Chen et al., 2000)); el P-His-HPr continua pudiendo fosforilar el PRD de regulación positiva y en este estado el antiterminador es activo. En presencia de glucosa, las proteínas del PTS están desfosforiladas debido al rápido transporte de glucosa, disminuye la cantidad de P-His-HPr y se produce P-Ser-HPr; dado que el el PRD necesario para la regulación positiva se encuentra desfosforilado, el antiterninador es inactivo (reprimido) con independencia de la presencia o ausencia del inductor. En base a lo anterior, LacT puede existir en tres formas (Gosalbes et al., 1999) (figura 8):
- Activo: cuando está desfosforilado en PRD-I y fosforilado en PRD-II (presencia de lactosa y asusencia de glucosa).
- Inactivo (no inducido): cuando LacT está fosforilado en ambos dominios (ausencia de lactosa y de glucosa).
- Inactivo (reprimido por catabolito): cuando el PRD-II está desfosforilado, el estado de fosforilación del PRD-I es irrelevante porque la desfosforilación de PRD-II tiene un efecto dominante en la inactivación de LacT (presencia de glucosa).
Referencias:
Alpert, C.A. & U. Siebers. 1997.The lac operon of Lactobacillus casei contains lacT, a gene coding for a protein of the BglG family of transcriptional antiterminators. J Bacteriol 179:1555-15562.
Amster-Choder, O. & A. Wright. 1992. Modulation of dimerization of a transcriptional antiterminator protein by phosphorylation. Science 257:1395-1397.
Bardowski, J., S.D. Erlich & A. Chopin. 1994. BglR protin, which belongs to the BglG family of transcriptional antiterminators, is involved in b-glucoside utilization in Lactococcus lactis. J Bacteriol 176:5681-5685.
Chen, Q., P.W. Postma & O. Amster-choder. 2000. Dephosphorilation of the Escherichia coli transcriptional antiterminator BglG by the sugar sensor BglF is the reversal of its phosphorilation. J Bacteriol 182:2033-2036.
Débarbouillé, M., M. Arnaud, A. Fouet, A. Klier & G. Rapoport. 1990. The sacT gene regulating the sacPA operon in Bacillus subtilis shares strong homology with transcriptional antiterminators. J Bacteriol 172: 3966-3973.
Görke, B. & B. Rak. 1999. Catabolite control of Escherichia coli regulatory protein BglG activity by antagonistically acting phosphorylations. EMBO J 18:3370-3379.
Gosalbes, M.J., V. Monedero, C.A. Alpert & G. Pérez-Martínez. 1997. Establishing a model to study the regulation of the lactose operon in Lactobacillus casei. FEMS Microbiol Lett 148:83-89.
Gosalbes, M.J., V. Monedero & G. Pérez-Martínez. 1999. Elements involved in catabolite repression and substrate induction of the lactose operon in Lactobacillus casei. J Bacteriol 181:3928-3934.
Idelson, M. & O. Amster-Choder. 1998. SacY, a transcriptional antiterminator from Bacillus subtilis, is regulated by phosphorylation in vivo. J Bacteriol 180:660-666.
Marasco, R., I. Salatiello, M. de Felipe & M. Sacco.2000. A physical and functional analysis of the newly-identified bglGPT operon of Lactobacillus plantarum. FEMS Microbiol Lett 186:269-279.
Monedero, V., M.J. Gosalbes & G. Pérez-Martínez. 1997. Catabolite repression in Lactobacillus casei ATCC 393 is mediated by CcpA. J Bacteriol 179:6657-6664.
Schnetz, K. & B. Rak. 1990. b-Glucoside permease represses the bgl operon of E. coli by phosphorylation of the antiterminator protein and also interacts with glucose-specific enzyme II, the key element in catabolic control. Proc Natl Acad Sci USA 87:5074-5078.
Schnetz, K., J. Stülke, S. Gertz, S. Krüger, M. Krieg, M. Hecker & B. Rak. 1996. LicT, a Bacillus subtilis transcriptional antiterminator protein of the BglG family. J Bacteriol 178: 1971-1979.
Stülke, J., I. Martin-Verstraete, M. Zagorec, M. Rose, A. Klier & G. Rapoport. 1997. Induction of Bacillus subtilis ptsGHI operon by glucose is controlled by a novel antiterminator, GlcT. Mol Microbiol 25:65-78.
Stülke, J., M. Arnaud, G. Rapoport & I. Martin-Verstraete. 1998. PRD, a protein domain involved in PTS-dependent induction and carbon catabolite repression of catabolic operons in bacteria. Mol Microbiol 28:865-874.
Tortosa, P., A. Aymerich, C. Lindner, M.H.Jr. Saier, J. Reizer & D. Le Coq. 1997. Multiple phosphorylation of SacY, a Bacillus subtilis antiterminator negatively controlled by the phosphotransferase system. J Biol Chem 272:17230-17237.
Veyrat, A., V. Monedero & G. Pérez-Martínez. 1994. Glucose transport by the phosphoenolpyruvate:mannose phosphotransferase system in Lactobacillus casei ATCC 393 and its role in carbon catabolite repression. Microbiology 140:1141-1149.

